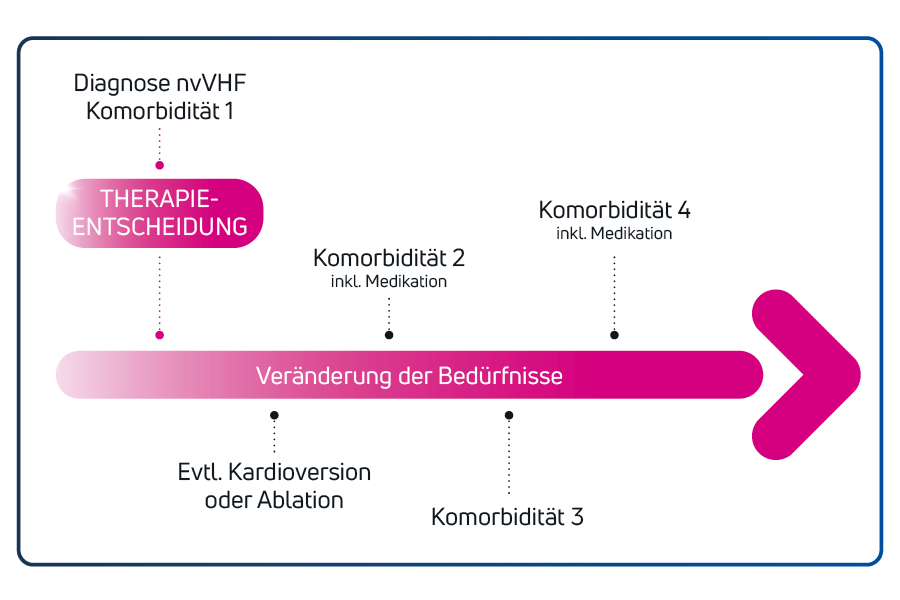
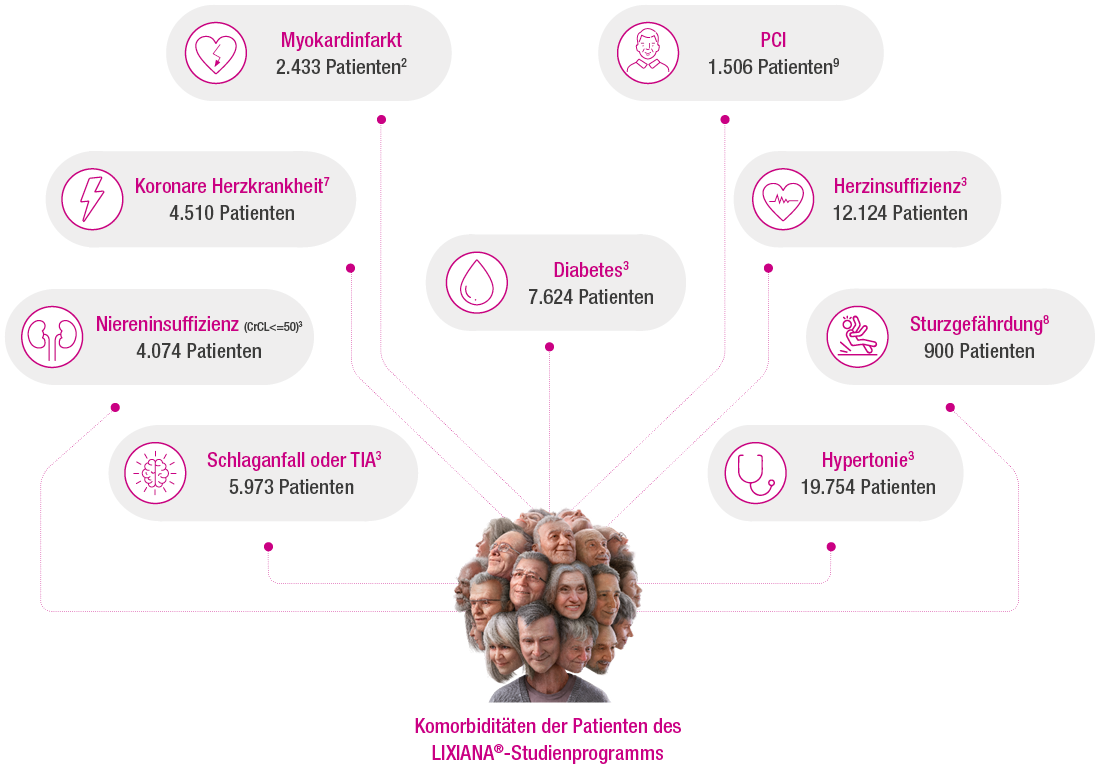
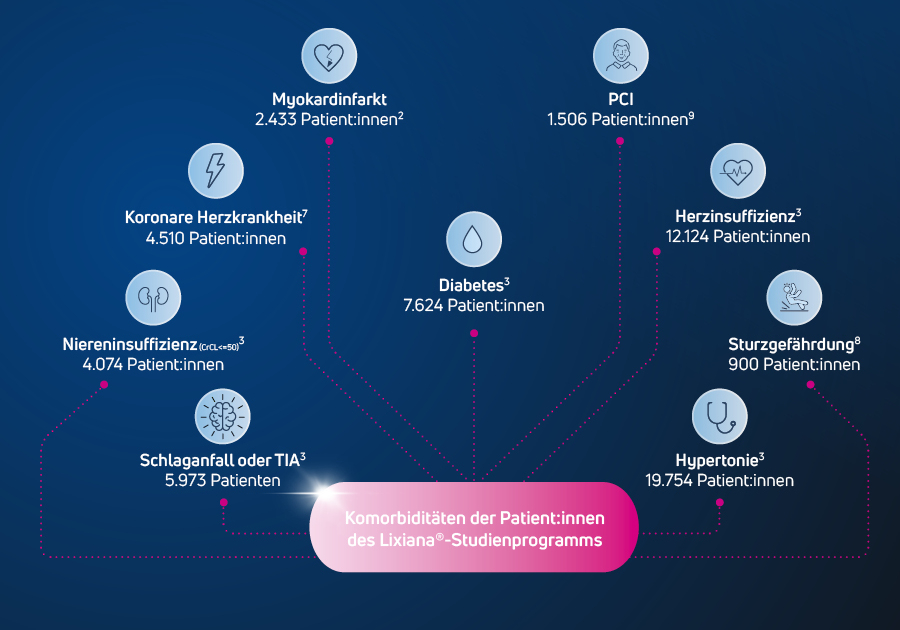
Entwickelt mit Fokus auf den
alternden nvVHF-Patienten
Daiichi Sankyo Deutschland GmbH ist Teil der weltweit tätigen Daiichi Sankyo Gruppe mit Hauptsitz in Japan. Wir bieten innovative Produkte und Dienstleistungen in mehr als 50 Ländern auf der ganzen Welt. Mit mehr als 100 Jahren der wissenschaftlichen Expertise gründet unser Unternehmen auf ein reiches Erbe an Innovation und eine robuste Pipeline von vielversprechenden neuen Medikamenten, um Patienten zu helfen.
©2023 Daiichi Sankyo Europe GmbH. All rights reserved.
Passion for Innovation. Compassion for Patients™
Daiichi Sankyo Europe GmbH
Zielstattstrasse 48, 81379 München
Haftungsausschluss: Diese Website enthält Informationen über LIXIANA® (Edoxaban), die auf der von der Europäischen Kommission genehmigten Zusammenfassung der Produktmerkmale (SmPC) basieren.